Stoikiometri adalah sebuah disiplin ilmu kimia yang membahas hubungan massa antar unsur dari sebuah senyawa (ini disebut stoikiometri senyawa) dan hubungan antar zat dalam suatu reaksi. Kata stoikiometri berasal dari bahasa Yunani stoicheion (yang berarti elemen/unsur) dan metron (yang berarti ukuran)
Dalam postingan kali ini, kita akan membahas komposisi unsur dalam suatu senyawa, konsep mol, hukum kekekalan massa (Antoine Laurent Lavoisier (1743 – 1794)), hukum perbandingan tetap (Joseph Louis Proust (1754 – 1826)), hukum kelipatan perbandingn (John Dalton), hukum perbandingan volume (Joseph Louis Gay Lussac (1778-1850)), dan Teori Avogadro (Amedeo Avogadro (1776–1857)).
Tidak perlu khawatir dengan banyaknya nama yang agak sulit diingat itu. Yang terpenting adalah, kita memahami konsep penemuan mereka dan menerapkannya dalam setiap soal kimia yang kita hadapi.
Oke.. kita mulai dengan hukum yang dipublikasikan oleh Lavoisier.
Hukum Kekekalan Massa
Massa zat-zat sebelum dan sesudah bereaksi adalah tetap. Dahulu Lavoisier mendapati bahwa logam 3 gram Magnesium direaksikan dengan 5 gram Oksigen maka akan menghasilkan 8 gram Magnesium Oksida. Mungkin kalian akan bertanya 'apakah jika magnesiumnya ditambah hasilnya akan sama atau bertambah?', atau pertanyaan 'bagaimana dengan reaksi yang menghasilkan gas'?.
Maka jawabnya adalah..., jika --misalnya-- magnesium ditambah menjadi 5 gram dan oksigennya tetap 5 gram, maka hasil reaksinya (atau biasa disebut produk) adalah 10 gram. Namun 10 gram yang terbentuk bukan magnesium oksida semua, tetapi 8 gram magnesium oksida dan 2 gram magnesium sebagai sisa reaksi (yang tidak ikut bereaksi). Bagaimana dengan reaksi yang menghasilkan gas?
Keseluruhan produk --termasuk gas-- akan sama beratnya dengan reaktan(pereaksi).
Hukum Perbandingan Tetap
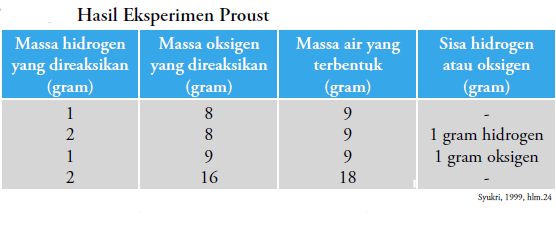
Sebagaiman contoh magnesium yang direaksikan dengan oksigen di atas. Ternyata dalam bereaksi dua unsur atau lebih akan membentuk produk dengan perbandingan penggunan reaktan yang tetap. Sebagaimana tabel hasil penemuan Proust
Kalian perhatikan tabel di atas.
Di baris pertama 1 gram hidrogen direaksikan dengan 8 gram oksigen menghasilkan 9 gram air.
Di baris kedua, saat hidrogen ditambah menjadi 2 gram, maka air yang terbentuk tetap 9 gram dan sisa 1 gram hidrogen.
Di baris ketiga, saat oksigen ditambah, hasil tetap 9 gram air dan tersisa oksigen sejumlah yang ditambahkantadi.
Reaktan akan tepat habis jika perbandingannya sebanding dengan perbandingan 1(H), 8(O) menghasilkan 9 (H2O), atau 2-16-18, atau 3-24-27 dan seterusnya... dengan perbandingan tetap.
Hukum Kelipatan Perbandingan
John Dalton menyatakan,
“Jika dua jenis unsur bergabung membentuk lebih dari satu senyawa, dan jika massa-massa salah satu unsur dalam senyawa-senyawa tersebut sama, sedangkan massa-massa unsur lainnya berbeda, maka perbandingan massa unsur lainnya dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana. “
Kalau masih bingung.. mari kita telaah tabel hasil penelitian John Dalton.
Dari tabeldi atas, untuk oksigen 1 gram ada dua kemungkinan bereaksi dengan nitrogen. yang pertama membentuk nitrogen monoksida dan yang kedua terbentuk nitrigen dioksida. Jika kita perbandingkan berat nitrogen pada nitrogen monoksida dan nitrogen dioksida = 1,75/0.875 maka akan dihasilkanbilangan bulat 2/1.
Setiap unsur dalam senyawa memiliki perbandingan bilangan bulat sederhana. Artinya, perbandingan yang bulat itu menunjukkan jumlah atom yang memang merupakan bilangan bulat. langsung saja kita sebut NO (yang artinya 1 atom N dan 1 atom O) dan NO2 (terdiri dari 1 atom N dan 2 atom O).
Hukum Perbandingan Volume
To the point aja.. Perhatikan koefisiennya 2-1-2, kalau 2 liter hidrogen direaksikan dengan oksigen, maka akan membutuhkan 1 liter oksigen (kalo nggak ada koefisien di depan huruf O2, berarti di situ ada angka 1) dan menghasilkan 2 liter air.
Kalau di buku ada beberapa perhitungan yang kayaknya agak njlimet. tapi intinya ya itu tadi. kalau misalnya gas hidrogen yang tersedia 4 liter, berarti ia akan membutuhkan 2 liter oksigen untuk kemudian mampu membentuk 4 liter air.
Yap.. keempat hukum itu akan kita gunakan dalam menyelesaikan setiap permasalahan dalam perhitungan kimia. Ditambah satu lagi yakni konsep Mol.
Konsep Mol
Oke.. soal konsep mol. Begini, kalian pernah beli beras? atau terigu? atau bensin mungkin? Yakin pernah kan? Nah kalian pernah beli beras, berapa harga per butirnya? He..he.., pasti pusing njawabnya kan?
Di situlah manfaat kata mol. Sama fungsinya seperti kg, atau lusin atau kodi atau liter. Hanya saja untuk kg dan liter memang juga menjadi satuan ukuran unsur dalam stoikiometri.
Mungkin saya akan ambil contoh lusin. kalau 1 lusin itu adalah 12 buah, maka 1 mol menyatakan 6,02 . 10^23 buah... (eh.. emang buah-buahan?). Oke kata 'buah' kita ganti dengan satuan benda kecil yakni partikel.
Partikel bisa berupa atom (C, Na, Fe), atau molekul (H2O, N2, NaOH) atau ion (OH-, H+ SO42-). Ah.. apa bener? (mungkin kalian bertanya begitu). ya.. itu kan kesepakatan, soal kenapa diambil angka itu ga akan saya jelaskan di sini. atau bisa ditanyakan langsung kepada mendiang Avogadro kalo memang masih penasaran... he...
Nah.., kalau kalian sudah paham bahwa maksud penggunaan kata mol adalah untuk mempermudah perhitungan, penyebutan yang mewakili mega-trilyunan partikel berarti kita bisa membahas bagan berikut.
Perhatikan bagan di atas. untuk anak panah yang mengarah ke mol berarti dibagi. Untuk anak panah yang mengarah keluar mol, maka dikali dengan angka yang ada di bagian bayangan hitam.
Sekarang, kita coba untuk latihan soal. Coba perhatikan beberapa soal berikut.
Soal No 1
Jika diketahui Ar N = 14, H = 1, S = 32, dan O = 16,
maka Mr (NH4)3SO4 adalah ....
A. 152
B. 142
C. 132
D. 122
E. 112
A. 152
B. 142
C. 132
D. 122
E. 112
Jawaban D
Mr (NH4)3SO4 = ((14 + 4(1)x3) + 32 + 4(16) = (14 +
12) + 32 + 64 = 122
Soal No 2
Jika dalam 1 liter gas SO2 mengandung n molekul SO2,
maka dalam 2 liter gas SO3 terdapat sebanyak ....
A. n
B. 2n
C. 4n
D. 20n
E. 40n
Jawaban B
Di sini saya hanya akan menjelaskan bahwa Volume-Mol-Partikel-KoefisienReaksi akan selalu sebanding. Coba kalian telaah dalam setiap soal, 99% polanya seperti itu (yang 1% mungkin cuma karena salah ketik atau yang ngerjain soalnya error..he..he..).
Ini sangat bermanfaat untuk memperingkas perhitungan kimia. Ini bukan pebjelasan.. hanya inspirasi..he..he..
Soal No 3
Jumlah mol dari 10 gram CaCO3 adalah ....
A. 25
B. 10
C. 1
D. 0,1
E. 0,01
Jawaban D
Mr CaCO3 = (40 + 12 + 3(16)) =100
Ar Ca= 40, Ar C = 12 dan Ar O = 16. Di sebagian soal, Mr tidak disebutkan. Oleh karena itu, Anda harus ingat massa setiap unsur.
Tapi jangan khawatir, tidak semua unsur harus anda hafal. Anda cukup menghafalkan Golongan A saja. Itu pun beberapa saja, tdk harus semua Anda hafal. Cukup Golongan IA(semua), IIA(semua), VIIIA/Gas Mulia(Semua), VIIA(Semua).. he..he.. itu mah semuanya.....
Ga kok.. untuk golongan IV, V, dan V hanya beberapa saja seperti N, O, C, dll, kalian nanti akan temukan sendiri di soal.
Tapi jangan khawatir, tidak semua unsur harus anda hafal. Anda cukup menghafalkan Golongan A saja. Itu pun beberapa saja, tdk harus semua Anda hafal. Cukup Golongan IA(semua), IIA(semua), VIIIA/Gas Mulia(Semua), VIIA(Semua).. he..he.. itu mah semuanya.....
Ga kok.. untuk golongan IV, V, dan V hanya beberapa saja seperti N, O, C, dll, kalian nanti akan temukan sendiri di soal.
Kita lanjut...
Saya menyertakan gambar konversi mol-gram-partikel di atas, sekedar menjelaskan bahwa untuk mengerjakan soal stoikiometri cukup dengan menggambar bagan di atas dan menyesuaikan mana yang diketahui dan mana yang dicari.
Tempatkan yang diketahui di bagiannya dan tempatkan yang dicari di bagiannya, Anda akan menemukan cara penyelesaiannya.
Tempatkan yang diketahui di bagiannya dan tempatkan yang dicari di bagiannya, Anda akan menemukan cara penyelesaiannya.
Soal No 4
Satu gram zat berikut yang mengandung jumlah molekul
paling sedikit adalah ....
(Ar O = 16, N = 14, H = 1, C = 12)
A. CH4
B. CO2
C. H2O
D. NO
E. NH3
Jawaban B
Mr CH4 = 12 + 4(1) = 16
Mr CO2 = 12 + 2 (16) = 44
Mr H2O = 2(1) + 16 = 18
Mr NO = 14 + 16 = 30
Mr NH3 = 14 + 3 (1) = 17
Tidak perlu kalian hitung. terlalu lama dan memakan waktu. . Bahkan dengan sering mengerjakan soal kalian akan mendapatkan pemahaman bahwa... semakin berat suatu unsur, maka per gramnya akan memuat partikel semakinsedikit.. Ingat, satu ton semut akan berisi jutaan semut, bandingkan dengan satu ton gajah. paling isinya cuman satu ekor... ^_^'
Soal No 5
Pada suhu tertentu 6 liter gas nitrogen direaksikan dengan gas hidrogen menghasilkan gas amonia. Jika pengukuran dilakukan pada suhu dan tekanan yang sama, maka tentukan:
a. persamaan reaksi setaranya;
b. volume gas hidrogen yang bereaksi;
c. volume gas amonia yang terbentuk!
Jawaban
a. Persamaan reaksi sudah ada di atas.
b. Volume gas hidrogen 18 liter
Volume gas amonia 12 liter.
Soal No 6
Jika perbandingan massa hidrogen dan oksigen dalam air adalah 1 : 8, maka untuk menghasilkan 45 gram air dibutuhkan ....
A. 5 gram hidrogen dan 40 gram oksigen
B. 40 gram hidrogen dan 5 gram oksigen
C. 5 gram hidrogen dan 8 gram oksigen
D. 5 gram hidrogen dan 9 gram oksigen
E. 45 gram hidrogen dan 5 gram oksigen
Jawaban A
Dalam soal tersebut, hirogen dan oksigen kebetulan habis bereaksi sehingga nampak jelas hukum kekekalan massan dimana 1 +8 = 9.
Soal No 7
Dua buah unsur A dan B dapat membentuk dua macam senyawa. Senyawa I mengandung A 25% dan senyawa B mengandung A 50%. Untuk A yang sama perbandingan B pada senyawa I dan II adalah ....
A. 1 : 2 D. 3 : 1
B. 1 : 3 E. 2 : 3
C. 2 : 1
Jawaban D
Soal No 8
Dua liter gas nitrogen direaksikan dengan gas hydrogen menghasilkan gas amonia sesuai reaksi:
N2(g) + H2(g) → NH3(g)
Jika diukur pada suhu dan tekanan yang sama, maka volume gas amonia yang dihasilkan ....
A. 1 liter D. 4 liter
B. 2 liter E. 6 liter
C. 3 liter
Jawaban D
Jadi, gas amonia yang dihasilkan adalah 4 liter.
Soal No 9
Bila 6 gram magnesium (Ar Mg = 24) dibakar di udara terbuka diperoleh 10 gram magnesium oksida, maka oksigen yang diperlukan adalah ... gram.
A. 16 D. 4
B. 10 E. 3
C. 6
Jawaban D
Jadi, gas oksigen yang dibuuhkan adalah 4 gram.
Soal No 10
Satu gram hidrogen dapat bereaksi dengan 8 gram oksigen, maka air yang terbentuk adalah ....
A. 1 gram D. 9 gram
B. 2 gram E. 10 gram
C. 8 gram
Jawaban D
Ya.. cukup sampai di sini materi stoikiometri. ke depan kitaakan belajar tentang reaksi yang memiliki sisa, kesetimbangan atau reaksi bolak-balik dan berbagai hal lain dalam dunia kimia.