I. Bilangan Kuantum
Hipotesis Louis de Broglie dan azas ketidakpastian dari Heisenberg merupakan dasar dari model Mekanika Kuantum (Gelombang) yang dikemukakan oleh Erwin Schrodinger pada tahun1927, mengajukan konsep orbital untuk menyatakan kedudukan elektron dalam atom.
Orbital menyatakan suatu daerah dimana elektron paling mungkin (peluang terbesar) untuk ditemukan. Persamaan gelombang (psi) dari Erwin Schrodinger menghasilkan tiga bilangan gelombang (bilangan kuantum) untuk menyatakan kedudukan (tingkat energi, bentuk, serta orientasi) suatu orbital, yaitu:
a. Bilangan kuantum utama (n)
Menentukan besarnya tingkat energi suatu elektron yang mencirikan ukuran orbital (menyatakan tingkat energi utama atau kulit atom). Bilangan kuantum utama memiliki harga mulai dari 1, 2, 3, 4,….dst (bilangan bulat positif).
Biasanya dinyatakan dengan lambang, misalnya K(n=1), L(n=2), dst.
Orbital–orbital dengan bilangan kuantum utama berbeda, mempunyai tingkat energi yang berbeda. Makin besar bilangan kuantum utama, kulit makin jauh dari inti, dan makin besar pula energinya.
b. Bilangan kuantum azimut (l )
Menyatakan subkulit tempat elektron berada. Nilai bilangan kuantum ini menentukan bentuk ruang orbital dan besarnya momentum sudut elektron. Nilai untuk bilangan kuantum azimuth dikaitkan dengan bilangan kuantum utama. Bilangan kuantum azimuth mempunyai harga dari nol sampai (n – 1) untuk setiap n.Setiap subkulit diberi lambang berdasarkan harga bilangan kuantum l.
• l = 0 , lambang s (sharp)
• l = 1, lambang p (principal)
• l = 2, lambang d (diffuse)
• l = 3, lambang f (fundamental)
(Lambang s, p, d, dan f diambil dari nama spektrum yang dihasilkan oleh logam alkali dari Li sampai dengan Cs).
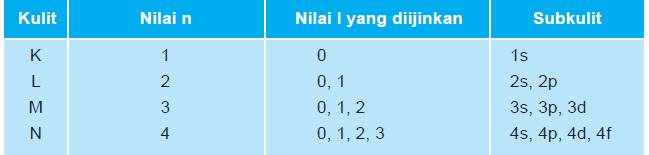 |
| Tabel Kulit dan Subkulit Atom |
c. Bilangan kuantum magnetik (ml)
Menyatakan orbital khusus mana yang ditempati elektron pada suatu subkulit. Selain itu juga dapat menyatakan orientasi khusus dari orbital itu dalam ruang relatif terhadap inti. Nilai bilangan kuantum magnetik bergantung pada bilangan kuantum azimuth, yaitu bilangan bulat dari –l sampai +l.Contoh:
l = 0, maka nilai m = 0 berarti hanya terdapat 1 orbital
l = 1, maka nilai m = –1, 0, +1, berarti terdapat 3 orbital
d. Bilangan kuantum spin (ms atau s)
Bilangan kuantum spin terlepas dari pengaruh momentum sudut. Hal ini berarti bilangan kuantum spin tidak berhubungan secara langsung dengan tiga bilangan kuantum yang lain. Bilangan kuantum spin bukan merupakan penyelesaian dari persamaan gelombang, tetapi didasarkan pada pengamatan Otto Stern dan Walter Gerlach terhadap spektrum yang dilewatkan pada medan magnet, ternyata terdapat dua spektrum yang terpisah dengan kerapatan yang sama.Terjadinya pemisahan garis spektrum oleh medan magnet dimungkinkan karena elektron-elektron tersebut selama mengelilingi inti berputar pada sumbunya dengan arah yang berbeda. Berdasarkan
hal ini diusulkan adanya bilangan kuantum spin untuk menandai arah putaran (spin) elektron pada sumbunya.
Hanya ada dua kemungkinan arah rotasi elektron, yaitu searah jarum jam dan berlawanan jarum jam, maka probabilitas elektron berputar searah jarum jam adalah dan berlawanan jarum jam . Untuk membedakan arah putarnya maka diberi tanda positif (+ ) dan negatif (– ).
Oleh karena itu dapat dimengerti bahwa satu orbital hanya dapat ditempati maksimum dua elektron.
II. Konfigurasi Elektron
Pada mekanika gelombang atau mekanika kuantum, elektron-elektron dalam suatu atom akan tersebar ke dalam orbital-orbital (s, p, d, f, dan seterusnya). Bagaimana pengisian elektron ke dalam orbital? Pengisian orbital oleh elektron mengikuti aturan dengan memperhatikan tiga hal, yaitu asasAufBau, asas larangan Pauli, dan asas Hund.
a. Asas AufBau
Menurut asas AufBau, pada kondisi normal atau pada tingkat dasar, elektron akan menempati orbital yang memiliki energi terendah terlebih dahulu dan diteruskan ke orbital yang memiliki energi lebih tinggi.Untuk memudahkan dalam pengisian elektron diberikan tahap-tahap pengisian elektron dengan menggunakan jembatan ingatan sebagai berikut.
Arah anak panah menyatakan urutan pengisian orbital. Dengan demikian urutan pengisian elektron berdasarkan gambar tersebut berurut-urut 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, dan
seterusnya. Pengisian elektron harus satu persatu dan setiap orbital hanya boleh diisi oleh maksimal 2 elektron.
Tabel di atas juga menggambarkan urutan elektron dalam menempati orbital di setiap kulit. Semakin ke atas, energi yang dibutuhkan untuk memasuki orbital semakin besar.
b. Asas larangan Pauli
Pada tahun 1928, Wolfgang Pauli (1900 – 1958) mengemukakan bahwa tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat bilangan kuantum yang sama. Dua elektron yang mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama dalam satu orbital, harus
mempunyai spin yang berbeda.
Kedua elektron tersebut berpasangan. Setiap orbital mampu menampung maksimum dua elektron. Untuk mengimbangi gaya tolak-menolak di antara elektron-elektron tersebut, dua elektron dalam satu orbital selalu berotasi dalam arah yang berlawanan.
Dengan kata lain, setiap orbital maksimal hanya dapat terisi 2 elektron dengan arah spin berlawanan. Sebagai contoh, pengisian elektron pada orbital 1s digambarkan sebagai berikut.
Jumlah elektron maksimal untuk tiap subkulit sama dengan dua kali dari jumlah orbitalnya.
orbital s maksimal 2 elektron,
orbital p maksimal 6 elektron,
orbital d maksimal 10 elektron, dan
orbital f maksimal 14 elektron,
c. Asas Hund
Frederick Hund, 1927 (dikenal Hund) mengatakan bahwa pengisian elektron pada orbital yang setingkat (energinya sama) dalam satu orbital adalah satu per satu dengan arah spin yang sama sebelum berpasangan. Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan.
Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi elektron dapat dituliskan dalam bentuk diagram orbital. Suatu orbital dilambangkan dengan strip, sedangkan dua elektron yang menghuni satu orbital dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya mengandung satu elektron, anak panah dituliskan mengarah ke atas.
Dalam kaidah Hund, dikemukakan oleh Friedrich Hund (1894 – 1968) pada tahun 1930, disebutkan bahwa
Untuk penulisan konfigurasi elektron yang mempunyai jumlah elektron besar dapat dilakukan penyederhanaan. Penyederhanaan dilakukan dengan menuliskan simbol dari unsur gas mulia yang"elektron-elektron dalam orbital-orbital suatu subkulit cenderung untuk tidak berpasangan. Elektron-elektron baru berpasangan apabila pada subkulit itu sudah tidak ada lagi orbital kosong."
mempunyai nomor atom di bawahnya, diikuti dengan penulisan kekurangan jumlah elektron setelah gas mulia tersebut.
d. Penyimpangan konfigurasi elektron
Berdasarkan eksperimen, terdapat penyimpangan konfigurasi elektron dalam pengisian elektron. Penyimpangan pengisian elektron ditemui pada elektron yang terdapat pada orbital subkulit d dan f.Penyimpangan pada orbital subkulit d dikarenakan orbital yang setengah penuh (d5) atau penuh (d10) bersifat lebih stabil dibandingkan dengan orbital yang hampir setengah penuh (d4) atau hampir penuh (d8 atau d9).
Dengan demikian, jika elektron terluar berakhir pada d4, d8 atau d9 tersebut, maka satu atau semua elektron pada orbital s (yang berada pada tingkat energi yang lebih rendah dari d) pindah ke orbital subkulit d.
Pada orbital f , sebagaimana dengan penyimpangan konfigurasi dalam orbital d, maka konfigurasi elektron yang berakhir pada orbital f juga mengalami penyimpangan.
Penyimpangan dalam pengisian elektron dalam orbital ini disebabkan oleh tingkat energi orbital saling berdekatan hampir sama. Penyimpangan ini berupa berpindahnya satu atau dua
elektron dari orbital f ke orbital d. Lihat beberapa contoh dalam tabel di bawah ini.
e. Penulisan konfigurasi elektron pada ion
Penulisan konfigurasi elektron di atas berlaku pada atom netral. Penulisan konfigurasi elektron pada ion yang bermuatan pada dasarnya sama dengan penulisan konfigurasi elektron pada atom netral.
Atom bermuatan positif (misalnya +x) terbentuk karena atom netral melepaskan elektron pada kulit terluarnya sebanyak x, sedangkan ion negatif (misalnya –y) terbentuk karena menarik elektron sebanyak y. Penulisan konfigurasi elektronnya hanya menambah atau mengurangi elektron yang dilepas atau ditambah sesuai dengan aturan penulisan konfigurasi elektron.
4. Hubungan konfigurasi elektron dan sistem periodik
Konfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Seperti telah kalian ketahui bahwa sifat-sifat unsur sangat tergantung pada jumlah elektron valensinya.
Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama (n), maka atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion).
Sedangkan nilai n (bilangan kuantum utama) yang terbesar menunjuk nomor periode unsur tersebut dalam sistem periodik unsur. Misal konfigurasi elektron unsur K sebagai berikut.
19K : 1s2 2s2 2p6 3s2 3p6 4s1.
Nilai n terbesar adalah 4, maka K menempati periode 4.
Untuk menentukan golongan unsur dalam sistem periodik berdasarkan konfigurasi elektron, perlu dilihat pada jenis dan jumlah elektron terluar yang menempati kulit yang sama.
Golongan utama (Golongan A), pada golongan ini elektron valensi menempati subkulit s atau subkulit s dan p.
Golongan transisi (Golongan B), pada golongan ini elektron valensi menempati subkulit s dan d. Untuk lantanida dan aktinida, elektron valensi menempati subkulit s dan f. Tapi jumlahnya tidak menentukan golongan, karena lantanida dan aktinida tidak mempunyai golongan.
III. Elektron Valensi
Elektron Valensi adalah elektron yang berperan dalam pembentukan ikatan kimia antar atom. Elektron valensi sering dijumpai (terutama padaatom unsur utama/Golongan A) sebagai elektron terluar dalam sebuah atom.Tabel di atas menunjukkan contoh konfigurasi elektron beberapa unsur. dan nampak elektron valensi adalah jumlah elektron di kulit paling akhir setiap unsur. Ini berlaku untuk unsur utama (Golongan A)
Untuk Golongan B, Aktinida dan Lantanida penentuan elektron valensi lebih rumit, tidak perlu khawatir, karena hampir seluruhpertanyaan dan soal terkait elektron valensi akan memunculkan unsur dari golongan A.
Mari kita lihat beberapa soal berikut..
1. Suatu isotop mempunyai 21 neutron dan nomor massa 40. Unsur tersebut mempunyai elektron valensi sebanyak ... .
A. 1 D. 6
B. 2 E. 9
C. 3
Jawab:
Neutron 21 dan no massa 40. berarti massa proton (yang nantinya juga akan seimbang dengan jumlah elektron) adalah 40 - 21. yaitu... 19.
Kita susun 19 elektron ke dalam masing-masing orbital...
Dari gambar kita ketahui bahwa elektron valensinya adalah 1. unsur tersebut juga terdapat pada Periode 4 (terakhir di 4s). Termasuk ke golongan IA (krn e valensinya 1)
Masih bingung...? Kita coba beberapa soal lagi.., dan kalian coba temukan polanya ya....
2. Diketahui 7N, 8O, 9F, 11Na, dan 12Mg. Yang mempunyai elektron valensi tertinggi adalah unsur … .
A. N D. Na
B. O E. Mg
C. F
Jawab:


e valensi 7N adalah 5 = 1s2 2s2 2p3
e valensi 8O adalah 6 = 1s2 2s2 2p4
e valensi 9F adalah 7 = 1s2 2s2 2p5
e valensi 11Na adalah 1 = 1s2 2s2 2p6 3s1
e valensi 12Mg adalah 2 = 1s2 2s2 2p6 3s2
Elektron valensi tertinggi adalah 7, pada unsur 9F
Seluruh soal terkait elektron valensi berkaitan dengan Golongan A saja.
Jauh lebih mudah kalau kalian bisa hafal sebagian Golongan A.
Golongan IA (e val 1): HeLiNaKawanRubiCsFransiska
Golongan IIA (e val 2): BeliManggaCariSirsakBaruRambutan
.
.
.
Golongan VIA ( e val 6): OSSeTePo
Golongan VIIA (e val 7): FClBrIAt
Golongan VIIIA (e val 8): Heboh Negeri Arab Karena Xenon dan Radon
Ya.. sampai di sini penjelasan saya mengenai konfigurasi elektron, bilangan kuantum, elektron valensi dan sistem periodik unsur. Jika kalian merasa perlu mendownload sistem periodik unsur, bisa didownload pada tautan di bawah ini. Selamat belajar... !
Download Sistem Periodik Unsur











